
点击右上角![]() 微信好友
微信好友
 朋友圈
朋友圈

请使用浏览器分享功能进行分享

近日,首药控股宣布其新一代WEE1选择性抑制剂SY-4835的临床I期试验正式启动。一时间将大众的注意力吸引到基于合成致死理论的WEE1抑制剂上,上一个基于该理论的成功商业化药物是大名鼎鼎的PARP抑制剂(聚腺苷二磷酸核糖聚合酶抑制剂,PARPi)。随着PARPi在卵巢癌、三阴性乳腺癌(TNBC)等癌种的成功拓展,业内对合成致死理论的热情近年来开始不断高涨。
2021年4月,诺华与针对DNA损伤应答的公司Artios Pharma达成一项将合成致死与靶向放射治疗相结合的协议,合作金额超13亿美元。
2020年8月,吉利德与“合成致死”平台公司TangoTherapeutics达成进一步超60亿美元的战略合作,合作开发“合成致死”新靶点,这是双方继2018年的近17亿美元合作后的再次加码。
2020年5月,百时美施贵宝与“合成致死”精准疗法公司Repare Therapeutics达成近38亿美元的合作,双方合作开发“合成致死”新靶点。
……
今天,我们把视线移至已有产品成功商业化运作的“合成致死”理论赛道,并就PARP抑制剂WEE1抑制剂、PRMT5/MAT2A抑制剂等三类抑制剂的机理及在研产品进行汇总,供大家参考。
1、合成致死理论
合成致死(Synthetic lethality)理论由来已久,通俗来讲,指两个非致死基因同时失活将导致细胞死亡的现象。概念最早可以追溯到1992年,美国科学家卡尔文在果蝇的研究中发现,具有pd和 Pdr双基因突变的果蝇不能存活,而这其中任何一个基因单独突变都不会导致果蝇死亡[1]。1946年,西奥多·多布赞斯基正式提出“合成致死”概念[2],用来描述这种不同基因之间的互补性致死作用。
科学家们很容易将果蝇中发现的这种现像与肿瘤治疗理论相结合,如果发现肿瘤细胞中存在特定基因A失活,那么用药物抑制它的合成致死搭档基因B,使两者都失活,而健康的体细胞因为有正常的基因A,能够保证正常的生理功能的表达,不会受到药物的伤害,从而只特异性的杀死该类肿瘤细胞 [3]。
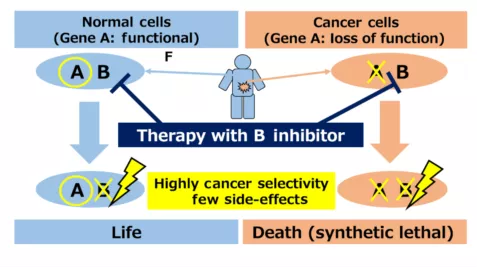
基于合成致死原理的肿瘤治疗
原理很简单,但难点相信大家也能想得到。没有技术的突破,你很难找到合适的成对存在的合成致死基因。犹如好的逗哏必须得有好的捧哏才能合演一场成功的相声。突破在于PARP与BRCA这对黄金搭档的世纪相遇,促进了PARP抑制剂的成功商业化上市,并在卵巢癌领域获得巨大成功,由此开启了基于“合成致死”理论进行药物开发的热潮。
2、PARP抑制剂概况
PARP与BRCA
在介绍PARPi之前,首先得介绍下PARP与BRCA的基本概念。PARP(聚腺苷二磷酸核糖聚合酶)在DNA单链碱基切除、修复过程中发挥着关键作用。BRCA是重要的抑癌基因与肿瘤易感基因,包括BRCA1及BRCA2。BRCA基因突变会导致基因组不稳定性显著增加,从而显著提高女性罹患乳腺癌、卵巢癌以及其他癌症(胰腺癌、子宫内膜癌、腹膜癌及宫颈癌等)的风险。在人体内,BRCA可与PARP共同作用于同源重组(HR)修复通路,这种双保险组合,可以有效保证体内DNA复制的正确性。但部分癌细胞,BRCA基因会突变,此时,人类如若开发出能够抑制PARP的药物,通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而可增强放疗以及烷化剂和铂类药物化疗的疗效。特别是对于携带BRCA突变的肿瘤细胞,理论上对PARP抑制剂的敏感度会更高。
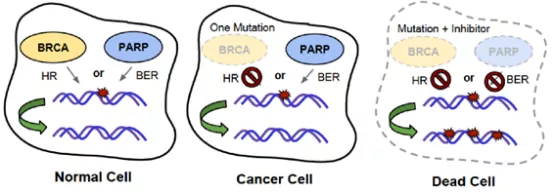
BRCA和PARP的合成致死示意图
已获批PARPi
目前,已经有四种PARP抑制剂在中国获批上市,分别是奥拉帕利、尼拉帕利、氟唑帕利以及帕米帕利,将这几款PARPi在卵巢癌领域获得FDA和NMPA批准的适应症总结如下:
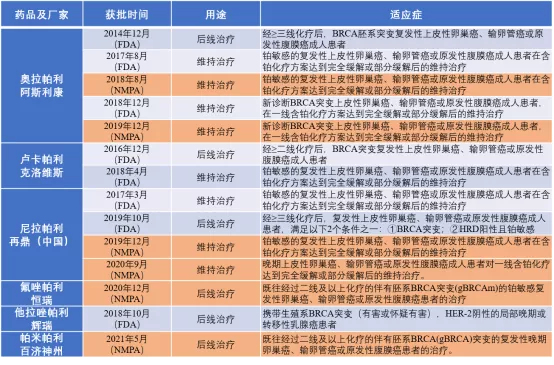
来源:NMPA、FDA、各公司官网
目前,奥拉帕利和尼拉帕利的适应症已经进入国家医保乙类目录,更好的惠及卵巢癌患者。同时,正如前文所说,PARPi不仅局限于卵巢癌领域,恒瑞已经针对氟唑帕利开展了26项临床研究,涉及小细胞肺癌、实体瘤、复发转移三阴乳腺癌、前列腺癌、复发性卵巢癌、晚期胃癌等,其中4项进入III期临床。另外,豪森药业的氟唑帕利以及百济神州的帕米帕利正处于上市申报阶段。此外,国内英派药业、君实生物、迪诺医药、青峰药业等的PARP抑制剂也分别进入临床III、II期。国内PARP抑制剂竞争日显白热化,也足见基于合成致死原理进行研发的抗肿瘤药物的威力,也期望能够在其他的靶点上重塑PARPi的辉煌。
3、WEE1抑制剂概况
2021年7月8日,首药控股方面宣布,其研发管线中的新一代WEE1选择性抑制剂SY-4835的临床I期试验正式启动。SY-4835是首药控股自主研发的具有完全知识产权的1类小分子创新药,它是一个新型的高选择性的WEE1抑制剂,可用于治疗多种难治性的实体肿瘤如胰腺癌、卵巢癌、结直肠癌、子宫浆液癌等。目前在WEE1抑制剂上,国内鲜少有企业布局,除了首药控股外,还有英派药业、迪诺医药等。
WEE1与TP53
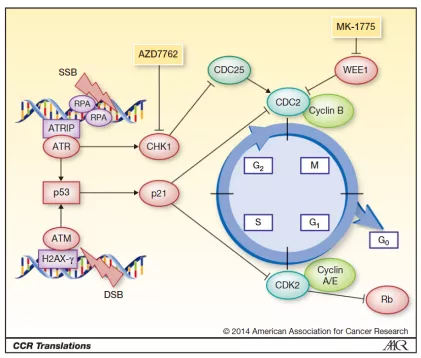
TP53 与 WEE1合成致死效应
WEE1 是丝氨酸/苏氨酸蛋白激酶家族中的一员,可通过磷酸化 CDK 的 Thr14 和 Tyr15 位点来抑制 CDK 激酶的活性,进而抑制细胞进入有丝分裂。与 WEE1 形成合成致死效应的搭档是大名鼎鼎的 TP53。对于TP53,相信大家并不陌生, TP53 基因翻译的P53蛋白是细胞生长、增殖和损伤修复的重要调节因子。正常情况下,当细胞的DNA受损时,P53蛋白会阻止细胞增殖而停止于G1/S期,直到损伤修复好后才能进入G2期,如不能修复则促进细胞凋亡。因此,TP53属于抑癌基因的范畴,在多种恶性肿瘤中会发生TP53突变,理论上,抑制WEE1,能够在多种癌症上显示抗肿瘤活性。
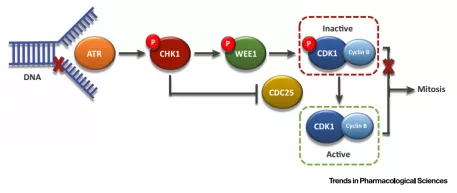
WEE1 在 G2/M 检查点中作用的示意图
WEE1抑制剂在研项目汇总
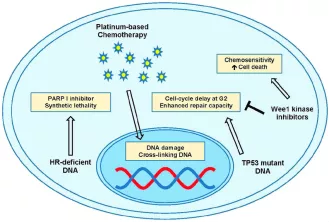
PARPi和WEE1抑制剂与化疗的增敏探索
目前,临床有多款 WEE1 抑制剂在研,进展最快的是 Adavosertib(AZD1775)。
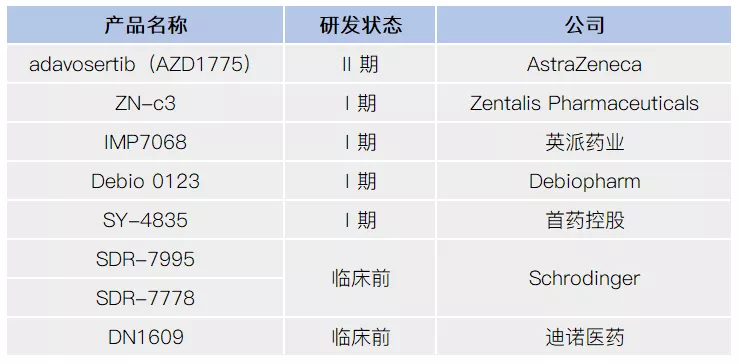
数据来源:医药魔方
Adavosertib在妇瘤领域中的浆液性子宫癌(USC)中效果非常不错。
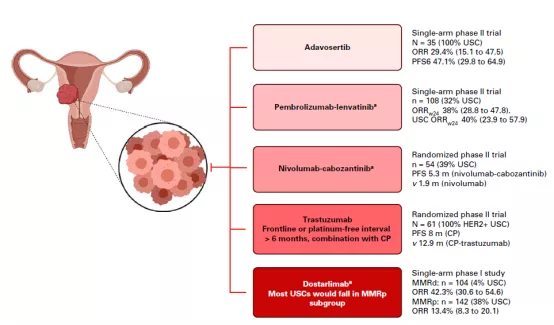
USC非化疗药物数据对比
普通化疗对USC疗效较差,近年来,Her-2靶向治疗,抗血管生成药,酪氨酸激酶抑制剂与免疫检查点抑制剂的结合,以及我们今天所介绍的WEE1细胞周期调节剂,在USC领域取得了不错的ORR和PFS数据。然而 Adavosertib 单药或联合用药均出现频率较高的不良事件,主要为腹泻、呕吐等胃肠道相关及贫血等血液方面不良事件, 对于Adavosertib 进一步的拓展蒙上了阴影。
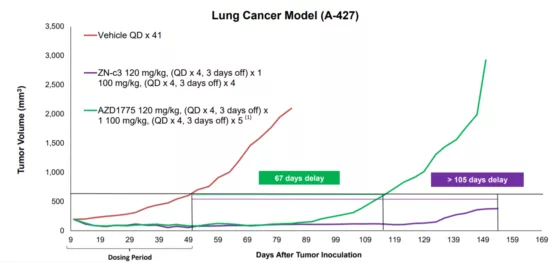
Adavosertib 和ZN-c3 模型数据对比
据报道,Zentalis公司开发的ZN-c3的选择性比AZD1775更好,并且其可溶性比AZD1775 高35倍,可以减少患者间药物暴露的差异并限制AZD1775临床试验中观察到的毒性。有潜力成为Best in class的WEE1抑制剂[7],雄心勃勃的Zentalis计划于2021年Q3开始联合化疗的1/2期卵巢癌和骨肉瘤试验,以及作为子宫浆液性癌单一疗法的II期试验。让我们拭目以待其未来的数据。
4、PRMT5/MTAP抑制剂
近年来,也有企业布局了PRMT5/MTAP合成致死组合靶点。
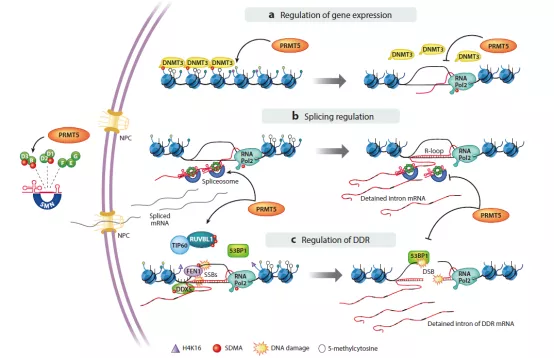
PRMT5在基因表达、剪接和DDR中的作用模型
PRMT(蛋白质精氨酸甲基转移酶)能够使多种蛋白甲基化,并在基因表达、剪接和DNA损伤修复等生物学过程中发挥重要作用。目前,已发现了11种PRMT家族的成员,主要的研究热点集中在PEMT5上。MTAP(methylthioadenosine phosphorylase,甲硫腺苷磷酸化酶)常与体内常见的抑癌基因CDKN2A发生共缺失现象,这种共缺失现象在肿瘤中的比例可达9%~15%。
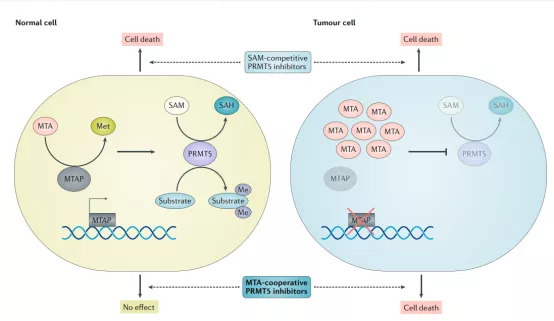
PRMT5和MTAP是合成致死组合
2016年的两篇背靠背《Science》文章首次报道了抑制PRMT5在MTAP缺失肿瘤中的合成致死效应。另外,有研究证明,MTAP缺失的癌细胞对蛋氨酸腺苷转移酶2A(MAT2A)也敏感。因此,PRMT5抑制剂和MAT2A抑制剂有望成为治疗MTAP缺失肿瘤的新一代靶向药物。
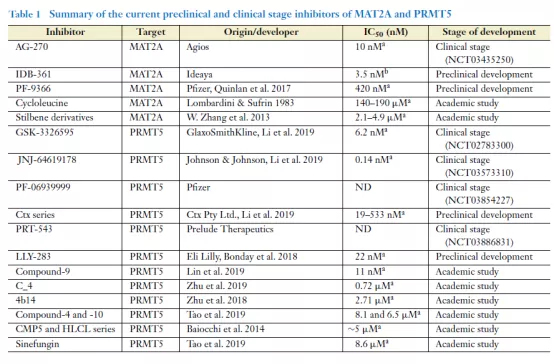
在研PRMT5/MAT2A抑制剂项目汇总
目前,有多款PRMT5/MAT2A抑制剂正在临床试验中,其中不乏GSK、辉瑞等大药企的身影,也有Agios这类新兴生物制药公司。让我们期待在肿瘤靶向药物治疗领域,“合成致死”理论能够再下一城。
总结
近年来,免疫检查点抑制剂的成功商业化上市,让肿瘤免疫治疗一时风光无限,并不断改写各个癌种的标准治疗方案。而随着竞争的加剧,研发逐步进入适应症扎推、靶点重叠、药物形式雷同的me-too式境地。尤其是2021年7月2日,CDE发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》,一时行业震动,而如何有效避开竞争的红海市场,寻找适合自己的差异化破局之法,将是一众药企最为核心的命题。
“合成致死”作为肿瘤治疗的新兴领域,引发了业内瞩目,只不过,国内一众企业目前多聚焦于已经商业化运作成功的PARPi的研发,鲜有突破创新者。当然,随着PARPi竞逐的激烈,WEE1抑制剂、PRMT 5/MTAP抑制剂的研发也会加速。让我们期待下一个基于合成致死原理的药品能够早日获批上市,造福更多患者。
参考文献
[1] Bridges, C.B., he origin of variations in sexual andsex-limited characters. Am.Nat., 1922. 56: p. 51-63.
[2] Dobzhansky, T., Genetics of natural populations;recombination and variability in populations of Drosophila pseudoobscura.Genetics, 1946. 31: p. 269-90.
[3] Cancer Science. 2020;111:774–782. DOI: 10.1111/cas.14311.
[4] CUNNINGHAM, A., SYNTHETIC LETHALITY: A NEW ANGLE FORCANCER THERAPY. 2017.
[3] http://dx.doi.org/10.1016/j.tips.2016.06.006.
[4] Int. J. Mol. Sci. 2017, 18, 2171; doi:10.3390/ijms18102171.
[5] Phase II Study of the WEE1 Inhibitor Adavosertib in Recurrent Uterine Serous Carcinoma. https://doi.org/10.1200/JCO.20.03167.
[6] https://doi.org/10.1200/JCO.21.00288.
本文作者:Biotech前瞻 原题:《合成致死疗法行业概览》
